Page 43 - ACER 5/21
P. 43
ARBORICOLTURA
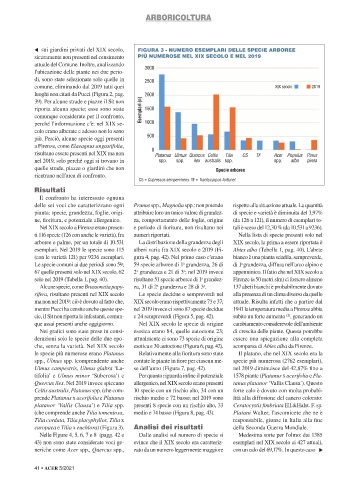
TABELLA 1 - CONFRONTO FRA LE SPECIE ARBOREE E ARBUSTIVE PRESENTI A FIRENZE s sui giardini privati del XIX secolo, FIGURA 3 - NUMERO ESEMPLARI DELLE SPECIE ARBOREE
RISPETTIVAMENTE NEL XIX SECOLO (a) E NEL 2019 (b) E PRESENTI IN ENTRAMBI I PERIODI (a) (b) sicuramente non presenti nel censimento PIÙ NUMEROSE NEL XIX SECOLO E NEL 2019
Abies alba (a) Crataegus spp. (b) Magnolia grandiflora ‘Ferruginea’ (a) Prunus cerasifera var. Pissardii (b) attuale del Comune. Inoltre, analizzando 3000
Abies cilicica (a) Cryptomeria japonica (a) Magnolia spp. (b) Prunus domestica (a) (b) l’ubicazione delle piante nei due perio-
Abies pinsapo (a) Cupressus arizonica (b) Magnolia x soulangeana (b) Prunus persica (a) (b) di, sono state selezionate solo quelle in 2500
Acacia dealbata (b) Cupressus funebris (a) Malus ‘Red Sentinel’ (b) Prunus spp. (a) (b) comune, eliminando dal 2019 tutti quei XIX secolo 2019
Acacia spp. (a) Cupressus macrocarpa (a) Malus spp. (a) (b) Pterocarya fraxinifolia (a) luoghi non citati da Pucci (Figura 2, pag. 2000
Acer campestre (a) (b) Cupressus sempervirens (a) (b) Melia azedarach (a) (b) Pyrus calleryana var. Chanticleer (b) 39). Per alcune strade e piazze il Sit non
Acer negundo (b) C. sempervirens ‘Horizontalis’ (a) Mespilus germanica (b) Pyrus communis (b) riporta alcuna specie; esse sono state Esemplari (n) 1500
Acer palmatum (b) C. sempervirens ‘Umbilicata’ (a) Michelia spp. (a) Pyrus spp. (a) comunque considerate per il confronto,
Acer platanoides (b) Cupressus spp. (b) Morus alba (a) (b) Quercus cerris (b) perché l’informazione c’è: nel XIX se- 1000
Acer pseudoplatanus (a) (b) Cupressus torulosa (a) Morus cucullata (a) Quercus crenata (a) (b) colo erano alberate e adesso non lo sono
Acer rubrum (b) Diospyros kaki (b) Morus nigra (b) Quercus ilex (a) (b) più. Perciò, alcune specie oggi presenti 500
Acer saccharinum (b) Diospyros kaki ‘Mazeli’ (a) Morus spp. (a) Quercus palustris (b) a Firenze, come Elaeagnus angustifolia,
Acer sempervirens (a) Elaeagnus angustifolia (a) Olea europaea (b) Quercus petraea (b) risultano essere presenti nel XIX ma non 0 Platanus Ulmus Quercus Celtis Tilia CS TF Acer Populus Pinus
Acer spp. (a) (b) Elaeagnus spp. (a) Ostrya carpinifolia (b) Quercus pubescens (b) nel 2019, solo perché oggi si trovano in spp. spp. ilex australis spp. spp. alba pinea
Acer x freemanii (b) Eriobotrya japonica (b) Ostrya virginiana (a) Quercus robur (a) (b) quelle strade, piazze o giardini che non Specie arboree
Aesculus flava (a) Fagus sylvatica (a) (b) Parrotia persica ‘Vanessa’ (b) Quercus rubra (b) rientrano nell’area di confronto.
A. hippocastanum (a) (b) Fagus sylvatica ‘Purpurea’ (a) Paulownia tomentosa (b) Quercus spp. (a) (b) CS = Cupressus sempervirens. TF = Trachycarpus fortunei.
A. hippocastanum Ficus carica (a) (b) Phoenix canariensis (a) (b) Quercus suber (a) (b) Risultati
‘Flore-pleno’ (a) Il confronto ha interessato ognuna
Aesculus pavia (a) Ficus spp. (a) Phoenix dactylifera (a) Robinia pseudoacacia (a) (b) delle sei voci che caratterizzano ogni Prunus spp., Magnolia spp.: non potendo rispetto alla situazione attuale. La quantità
Aesculus x carnea (b) Firmiana simplex (b) Phoenix sylvestris (a) R. pseudoacacia ‘Monophylla’ (a) pianta: specie, grandezza, foglie, origi- attribuire loro un unico valore di grandez- di specie e varietà è diminuita del 3,97%
Ailanthus altissima (a) (b) Fraxinus americana (a) Picea abies (a) (b) Salix alba (b) ne, fioritura, e potenziale allergenico. za, comportamento delle foglie, origine (da 126 a 121), il numero di esemplari to-
Ailanthus spp. (a)* Fraxinus excelsior (b) Pinus nigra (a) (b) Salix babylonica (b) Nel XIX secolo a Firenze erano presen- e periodo di fioritura, non risultano nei tali è sceso del 12,30 % (da 10.531 a 9236).
Albizia julibrissin (a) (b) Fraxinus excelsior ‘Aurea’ (a) Pinus nigra laricio (a) Sequoiadendron giganteum (a) ti 116 specie (126 con anche le varietà), fra numeri riportati. Nella lista di specie presenti solo nel
Alnus cordata (a) (b) Fraxinus ornus (a) Pinus pinea (a) (b) Sophora japonica ‘Pendula’ (b) arboree e palme, per un totale di 10.531 La distribuzione della grandezza degli XIX secolo, la prima a essere riportata è
Alnus spp. (a) Fraxinus oxycarpa ‘Raywood’ (b) Pinus pinea ‘Fragilis’ (a) Sophora japonica (a) (b) esemplari. Nel 2019 le specie sono 115 alberi varia fra XIX secolo e 2019 (Fi- Abies alba (Tabella 1, pag. 40). L’abete
Pinus pyrenaica (con le varietà 121) per 9236 esemplari. gura 4, pag. 42). Nel primo caso c’erano bianco è una pianta sciafila, sempreverde,
Broussonetia papyrifera (a)* Fraxinus oxycarpa (a) (b) Sophora spp. (a)
(Pinus sylvestris ‘Pyrenaica’) (a) Le specie comuni ai due periodi sono 59; 59 specie arboree di 1 grandezza, 26 di di 1 grandezza, diffusa nell’arco alpino e
a
a
Calocedrus decurrens (a) (b) Ginkgo biloba (a) (b) Pinus sabiniana (a) Sorbus domestica (a) 67 quelle presenti solo nel XIX secolo, 62 2 grandezza e 21 di 3 ; nel 2019 invece appenninico. Il fatto che nel XIX secolo a
a
a
Gleditsia caroliniensis a
Carpinus betulus (b) Pinus smithiana (a) Tamarix gallica (b) solo nel 2019 (Tabella 1, pag. 40). risultano 51 specie arboree di 1 grandez- Firenze (a 50 metri slm) ci fossero almeno
(G. aquatica) (a) za, 31 di 2 grandezza e 28 di 3 . 137 abeti bianchi è probabilmente dovuto
a
a
Alcune specie, come Brussonetia papy-
Castanea spp. (a) Gleditsia sinensis (a) Pinus spp. (a) Taxus baccata (a) (b) rifera, risultano presenti nel XIX secolo Le specie decidue e sempreverdi nel alla presenza di un clima diverso da quello
Catalpa bignonioides (a) (b) Gleditsia spp. (a) Pinus sylvestris ‘Rigensis’ (a) Taxus baccata ‘Fastigiata’ (a) ma non nel 2019: ciò è dovuto al fatto che, XIX secolo erano rispettivamente 73 e 37; attuale. Risulta infatti che a partire dal
Catalpa bungei (a) G. triacanthos ‘Sunburst’ (b) Pinus wallichiana (a) (b) Thuja occidentalis (b) mentre Pucci ha censito anche queste spe- nel 2019 invece ci sono 87 specie decidue 1941 la temperatura media a Firenze abbia
Cedrus atlantica (a) (b) G. triacanthos (a) (b) Platanus orientalis (a) (b) Thuja spp. (a) (b) cie, il Sit non riporta le infestanti, comun- e 24 sempreverdi (Figura 5, pag. 42). subito un forte aumento , generando un
(5)
Cedrus deodara (a) (b) Gymnocladus dioicus (a) Platanus Platanor ‘Vallis Clausa’ (b) Tilia americana (a) (b) que assai presenti anche oggigiorno. Nel XIX secolo le specie di origine cambiamento considerevole dell’ambiente
Cedrus libani (a) (b) Hovenia dulcis (b) Platanus spp. (a) Tilia argentea (a) Nei grafici sono state prese in consi- esotica erano 84, quelle autoctone 23; di crescita delle piante. Questa potrebbe
Cedrus spp. (a) (b) Ilex aquifolium (a) (b) Platanus x acerifolia (b) Tilia cordata (b) derazioni solo le specie delle due epo- attualmente ci sono 73 specie di origine essere una spiegazione alla completa
Celtis australis (a) (b) Juglans nigra (a) (b) Platycladus orientalis (b) Tilia platyphyllos (a) (b) che, senza la varietà. Nel XIX secolo esotica e 30 autoctone (Figura 6, pag. 42). scomparsa di Abies alba da Firenze.
Celtis laevigata (b) Juglans regia (a) (b) Populus alba (a) (b) Tilia spp. (a) (b) Relativamente alla fioritura sono state Il platano, che nel XIX secolo era la
Populus angulata le specie più numerose erano Platanus
Celtis occidentalis (a) (b) Juglans spp. (a) (Populus deltoides) (a) Tilia x euchlora (b) spp., Ulmus spp. (comprendente anche contate le piante in fiore per ciascun me- specie più numerosa (2762 esemplari),
Cephalotaxus fortunei (a) Koelreuteria paniculata (b) Populus nigra (a) (b) Tilia x europaea (b) Ulmus campestris, Ulmus glabra ‘La- se dell’anno (Figura 7, pag. 42). nel 2019 diminuisce del 42,87% fino a
Cephalotaxus harringtonii (a) Laburnum anagyroides (a) (b) Populus nigra ‘Italica’ (a) (b) Ulmus campestris (a) tifolia’ e Ulmus minor ‘Suberosa’) e Per quanto riguarda infine il potenziale 1578 piante (Platanus x acerifolia e Pla-
Cercidiphyllum japonicum (b) Lagerstroemia indica (b) Populus spp. (a) Ulmus glabra (b) Quercus ilex. Nel 2019 invece spiccano allergenico, nel XIX secolo erano presenti tanus platanor ‘Vallis Clausa’). Questo
Cercis siliquastrum (a) (b) L. indica ‘Rosea’ (a) Populus x canadensis (a) Ulmus glabra ‘Latifolia’ (a) Celtis australis, Platanus spp. (che com- 10 specie con un rischio alto, 34 con un forte calo è dovuto con molta probabi-
Chamaerops excelsa L. indica ‘Violacea’ (a) Populus x canescens (b) Ulmus minor (b) prende Platanus x acerifolia e Platanus rischio medio e 72 basso; nel 2019 sono lità alla diffusione del cancro colorato:
(Trachycarpus fortunei) (a) platanor ‘Vallis Clausa’) e Tilia spp. presenti 8 specie con un rischio alto, 33 Ceratocystis fimbriata Ell.&Halst. F. sp.
Cinnamomum camphora (a) Laurus nobilis (a) (b) Prunus amygdalus (b) Ulmus minor ‘Suberosa’ (a) (che comprende anche Tilia tomentosa, medio e 74 basso (Figura 8, pag. 43). Platani Walter, l’ascomicete che ne è
Corylus avellana (b) Liquidambar styraciflua (a) (b) Prunus armeniaca (b) Ulmus spp. (a) (b) Tilia cordata, Tilia platyphyllos, Tilia x responsabile, giunse in Italia alla fine
Corylus colurna (a) (b) Liriodendron tulipifera (a) (b) Prunus avium (b) Zelkova serrata (b) europaea e Tilia x euchlora) (Figura 3). Analisi dei risultati della Seconda Guerra Mondiale.
Crataegus azarolus (b) Magnolia grandiflora (a) (b) Prunus cerasifera (b) Zelkova spp. (b) Nelle Figure 4, 5, 6, 7 e 8 (pagg. 42 e Dalle analisi sul numero di specie si Medesima sorte per l’olmo: dai 1385
Legenda: (a) = Specie presente nel XIX secolo a Firenze. (b) = Specie presente nel 2019 a Firenze. *) = Specie infestante presente anche nel 2019 ma non censita. 43) non sono state considerate voci ge- evince che il XIX secolo era caratteriz- esemplari nel XIX secolo ai 427 attuali,
Nomenclatura aggiornata ad aprile 2019: alcune voci come Sophora japonica (attuale Styphnolobium japonicum) pertanto non risultano aggiornati. neriche come Acer spp., Quercus spp., zato da un numero leggermente maggiore con un calo del 69,17%. In questo caso t
41 • ACER 5/2021